Artemisinin-Resistenz bei Malariaparasiten entschlüsselt
Hamburg / Nijmegen, 3. Januar 2020 – Die Arbeitsgruppe um Tobias Spielmann am Bernhard-Nocht-Institut für Tropenmedizin (BNITM) hat den Mechanismus identifiziert, der für die Resistenz gegen das zurzeit wichtigste Malariamedikament Artemisinin verantwortlich ist. Dabei spielt das Parasitenprotein Kelch13 eine Schlüsselrolle. Die Ergebnisse, die die Hamburger Gruppe zusammen mit Kooperationspartnern von der Radboud Universität in Nijmegen aus den Niederlanden erzielt haben, wurden heute in der Fachzeitschrift Science veröffentlicht (Birnbaum & Scharf et al. 2020).
Plasmodium falciparum, der Erreger der Malaria tropica, ist mit jährlich über 200 Millionen Neuinfektionen und mit über 400.000 Todesfällen einer der bedeutendsten Infektionserreger des Menschen. Um die Malaria zu behandeln, werden in erster Linie Kombinationspräparate eingesetzt, die den Wirkstoff Artemisinin enthalten. Allerdings ist der Erfolg dieser Behandlung durch Resistenzen des Erregers zunehmend bedroht. Frühere Beobachtungen hatten gezeigt, dass ein Zusammenhang zwischen Veränderungen (Mutationen) im Protein „Kelch13“ des Malariaparasiten und dem Auftreten von Artemisinin-Resistenzen besteht. Es war jedoch bislang unklar, welche Funktion Kelch13 in der Parasitenzelle ausübt und wie Kelch13-Mutationen Resistenz verursachen.
Malariaparasiten vermehren sich in roten Blutzellen und ernähren sich durch Aufnahme und Verdauung des roten Blutfarbstoffs Hämoglobin. Mit Hilfe umfangreicher zellbiologischer Untersuchungen und unter Verwendung aufwendig hergestellter gentechnisch veränderter Parasiten konnte die Arbeitsgruppe um Spielmann jetzt zeigen, dass Kelch13 mit anderen Proteinen zusammenwirkt, die für die Aufnahme des Hämoglobins in die Parasitenzelle verantwortlich sind. „Erst die Identifikation von Kelch13-Partnerproteinen hat uns den entscheidenden Hinweis gegeben, welche Funktion Kelch13 in der Parasitenzelle ausüben könnte", beschreibt Spielmann die Arbeit seiner Gruppe. „Die gezielte Inaktivierung von Kelch13 bestätigte diese Vermutung und führte in der Tat zu einer verminderten Hämoglobin-Aufnahme.“
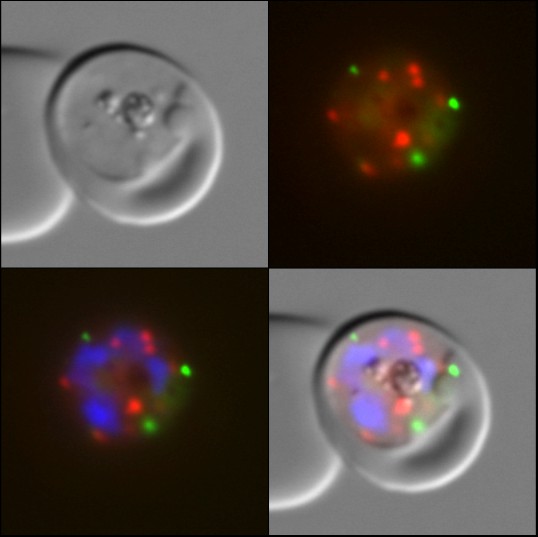
Weniger ist mehr: Kelch-Mutanten im Vorteil bei Artemisinineinsatz
Um seine toxische Wirkung entfalten zu können, muss Artemisinin nach Aufnahme in die Parasitenzelle aktiviert werden: Der Malariaparasit nimmt Hämoglobin auf, verdaut die Nahrung und produziert dabei Hämoglobinaubbauprodukte. Diese Abbauprodukte aktivieren in der Malariazelle den Wirkstoff Artemisinin; der Parasit stirbt.
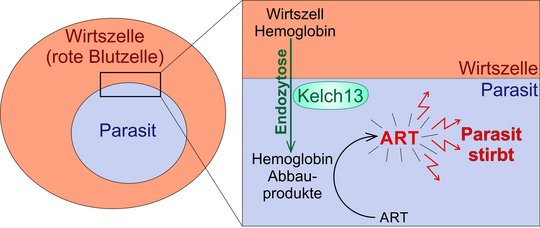
Der Malariaparasite gewinnt in einem 'Endozytose' genannten Prozess Hemoglobin aus der Wirtszelle (rote Blutzelle). Das Hemoglobin benötigt er als Nahrungsquelle. Die durch den Abbau von Hemoglobin entstehenden Degradationsprodukte sind nötig, um das Malariamedikament Artemisinin (ART) zu aktivieren, sodass es seine toxische Wirkung auf den Parasiten entfalten kann. In dieser Studie wurde herausgefunden, dass das Parasitenprotein Kelch13 und seine Interaktoren für die Endozytose von Hemoglobin zuständig sind. ART-resistente Parasiten besitzen eine veränderte Form von Kelch13, die in geringerer Menge in der Zelle vorhanden ist. Dadurch wird weniger Hemoglobin aufgenommen und weniger ART aktiviert. Dies ermöglicht dem Parasiten, in der Gegenwart von ART zu überleben und das veränderte Kelch13 vermittelt dadurch Resistenz gegen dieses Medikament. Quelle: BNITM.

„Eigentlich handelt es sich bei der Arteminisin-Resistenz um eine sehr feinsinnige Balance zwischen Nahrungsaufnahme und Artemisinin-Aktivierung“, fasst Spielmann die Ergebnisse zusammen. „Zum einen muss der Parasit trotz verringerter Hämoglobinaufnahme noch genügend Nahrung zu sich nehmen, um zu überleben, zum anderen darf er gerade nur so viel Hämoglobin aufnehmen, dass Artemisinin nicht mehr ausreichend aktiviert wird“, erklärt der Gruppenleiter. Die Erkenntnisse könnten helfen, verbesserte Malariamedikamente zu entwickeln, um der zunehmenden Artemisinin-Resistenz zu begegnen.
Weiterführende Informationen:
- Veröffentlichung in der Fachzeitschrift Science
A Kelch13-defined endocytosis pathway mediates artemisinin resistance in malaria parasites. Birnbaum & Scharf et al., Science 03 Jan 2020:Vol. 367, 6473: 51-59; DOI: 10.1126/science.aax4735 - Arbeitsgruppe Malaria
- Institute for Molecular Life Sciences, Radboud University
In Verbindung stehende Artikel:
Europäischer Forschungsrat fördert Spitzenforschung zur Antibiotikaresistenz von Malariaparasiten - 22.04.2021 12:05
Weltmalariatag am 25. April 2021 - 20.04.2021 18:50
Kindgerechte Malariamedikamente sind wirksam und besser verträglich - 23.12.2020 16:48
Krankheiten verhindern: Implementationsforschung für bessere Gesundheit weltweit - 13.01.2020 13:34
Weltmalariatag: Dialog mit BNITM-Experten im KörberForum - 26.04.2019 00:00
Einen Schritt voraus sein: Mit neuer Kombinations-Therapie gegen resistente Malariaerreger - 12.03.2019 00:00
Wie Malariaparasiten fressen – erster bedeutender Baustein entdeckt - 16.01.2019 11:37
Ansprechperson
Dr. Tobias Spielmann
Research group leader
Telefon : +49 40 285380-486
E-Mail : spielmann@bnitm.de
Dr. Eleonora Schönherr
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-269
E-Mail : presse@bnitm.de
Prof. Richárd Bártfai
Gruppenleiter an der Radboud University Netherland
Telefon : +31 24 3610561
E-Mail : r.bartfai@science.ru.nl






