Wie Malariaparasiten fressen – erster bedeutender Baustein entdeckt
Die Gruppe um Dr. Tobias Spielmann vom Bernhard-Nocht-Institut für Tropenmedizin (BNITM) hat die Nahrungsaufnahme von Malariaparasiten untersucht und dabei ein wichtiges Schlüsselmolekül identifiziert, das Angriffspunkt für die Entwicklung neuer Malariamedikamente sein könnte.
Aktives VPS45 (links): Hämoglobin-Aufnahme. Inaktives VPS45 (rechts): keine Nahrungsaufnahme, der Parasit stirbt.
Nach Angaben der Weltgesundheitsorganisation (WHO) erkranken jährlich mehr als 200 Millionen Menschen an einer Malaria von denen mehr als 400.000 an den Folgen der parasitären Infektionskrankheit sterben. Wichtigster Erreger ist Plasmodium falciparum, der für die schwersten Krankheitsverläufe der Malaria verantwortlich ist und zunehmend Resistenzen gegen die zur Verfügung stehenden Malariamedikamente entwickelt. „Die Wissenschaft ist gefordert, regelmäßig neue Medikamente zu entwickeln. Wir betreiben Grundlagenforschung, um kritische Stoffwechselwege des Parasiten zu identifizieren, die mögliche Angriffspunkte für neue Therapien sein könnten “, erklärt Spielmann, Arbeitsgruppenleiter in der Malariaforschung am BNITM.
Der Malariaparasit entwickelt und vermehrt sich in den roten Blutkörperchen des Menschen, den sogenannten Erythrozyten. Die Parasiten-bedingten Veränderungen und Zerstörungen der roten Blutzellen sind verantwortlich für die typischen Symptome einer Malariainfektion. Hauptbestandteil der Erythrozyten ist der rote Blutfarbstoff, das Hämoglobin. Das eisenhaltige Eiweiß dient dem Parasiten als Nahrungsquelle. Um das Hämoglobin verwerten zu können, werden innerhalb weniger Stunden 80 Prozent des Eiweißes in den Parasiten transportiert.
„Bisher war es gänzlich ungeklärt, über welchen molekularen Mechanismus der Erreger das Hämoglobin aus dem Erythrozyten in sein Verdauungsorgan, die sogenannte Fressvakuole überführt“, so Spielmann. Die Arbeitsgruppe hat in einer aktuellen Forschungsarbeit gezeigt, dass ein Protein namens VPS45 eine Schlüsselrolle im Transportweg des Hämoglobins einnimmt.
„Wir haben Methoden entwickelt, um Proteine des Parasiten auf Knopfdruck zu inaktivieren. Machen wir dies mit VPS45, so kann der Erreger kein Hämoglobin mehr aufnehmen und stirbt“, verdeutlicht Spielmann die Bedeutsamkeit des neu identifizierten Schlüsselproteins.
Die Forschungsergebnisse hat die Gruppe um Spielmann aktuell in der Fachzeitschrift Cell Host & Microbes veröffentlicht: doi.org/10.1016/j.chom.2018.11.010
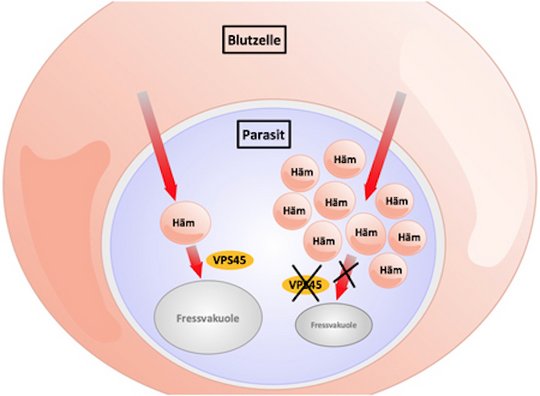
Grafik nach Jonscher et al., Cell Host & Microbes, 2019:
Parasit in Blutzelle. Aktives Schlüsselprotein (VPS45): Das Hämoglobin wird als Portion bis zur Fressvakuole des Parasiten transportiert (linker Weg). Inaktives VPS45-Protein: Prozess ist unterbrochen. Die Hämoglobin-Portionen erreichen die Fressvakuole nicht mehr und sammeln sich im Parasiten an; der Parasit stirbt (rechter Weg).
In Verbindung stehende Artikel:
Artemisinin-Resistenz bei Malariaparasiten entschlüsselt - 03.01.2020 00:05
Ansprechperson
Dr. Tobias Spielmann
Research group leader
Telefon : +49 40 285380-486
E-Mail : spielmann@bnitm.de
Dr. Eleonora Schönherr
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-269
E-Mail : presse@bnitm.de






