Bekämpfung oder Ko-Existenz?
Überraschende Forschungsergebnisse zur Hauptüberträgerin des Lassavirus in Westafrika
Die Vielzitzenmaus (Mastomys natalensis) ist die Hauptüberträgerin des Lassavirus. Eine Studie der Arbeitsgruppe Zoonosenkontrolle sät Zweifel, ob sich ihre jährliche Bekämpfung dazu eignet, die Ausbreitung des Lassafiebers einzudämmen. Die Ergebnisse sind im Wissenschaftsjournal "Emerging Microbes & Infections" erschienen.

Nomen est omen: Die Vielzitzenmaus kann rund 20 Jungtiere werfen und säugen, und das mitunter alle 28 Tage. Mastomys natalensis-Weibchen haben auf der Unterseite zwei Reihen mit jeweils bis zu zwöf Zitzen – Rekord im Mäusereich und Problem für die Menschen in vielen Regionen Westafrikas. Die nachtaktive Mastomys zerstört nicht nur Ernten und raubt Dorfbewohnern den Schlaf. Sie kann auch das Lassavirus (LASV) übertragen.
Dieses Arenavirus löst das Lassafieber aus. Meist verläuft die Krankheit ohne oder mit nur milden Symptomen. Aber besonders Schwangere, Babys und Kleinkinder können ein hämorrhagisches Fieber mit schweren inneren Blutungen und Gehirnentzündungen erleiden. Kommt es unmittelbar vor oder nach der Geburt zur Infektion, beträgt die Todesrate bei Säuglingen etwa 80 Prozent.
In vielen Ländern Westafrikas ist das Virus endemisch, also fest etabliert. Nach Schätzungen der Weltgesundheitsorganisation (WHO) erkranken weltweit jedes Jahr rund 100.000 bis 300.000 Menschen, 5.000 sterben an den Folgen der Infektion (ein bis zwei Prozent).
Lassaviren: Arenaviren der höchsten biologischen Sicherheitsstufe 4
Für die Behandlung des Lassafiebers gibt es keine ursächliche Therapie. Sie besteht in der Regel aus unterstützenden Maßnahmen, um die Symptome zu lindern und Komplikationen zu vermeiden. Dazu gehört unter anderem die Gabe von Flüssigkeiten, Medikamenten gegen Fieber und Schmerzen sowie Sauerstoff. Das antivirale Medikament Ribavirin wirkt nur, wenn es frühzeitig verabreicht wird.
An der Entwicklung von Schutzimpfungen wird gearbeitet, aber noch steht kein zugelassener Impfstoff zur Verfügung. Lassafieber-Bekämpfung ist daher zu einem großen Teil immer noch Nagetierbekämpfung, ganz klassisch mit Mausefallen und Rodentiziden. Die Idee dahinter: Wenn es gelingt, die Mäusepopulation gering zu halten, gelingt es auch, die Ausbreitung des Lassavirus einzudämmen.
Das war auch die Arbeitshypothese einer groß angelegten Studie unter der Leitung der Ökologin Dr. Elisabeth Fichet-Calvet. Sie leitet inzwischen die Arbeitsgruppe Zoonosenkontrolle in der Sektion Implementationsforschung am BNITM. Sieben Jahre lang experimentierte das Team in sechs Dörfern einer ländlichen Region Oberguineas in Westafrika. Mit einer jährlichen Nagetierbekämpfung gelang es ihm, die Population jedes Mal um bis zu 80 Prozent zu verringern. Auch die Lassavirus-Belastung in den Mäusen ging zurück, allerdings nur um fünf Prozent. Das stand in keinem Verhältnis zum Aufwand. Außerdem vermehrten sich die Mäuse hinterher extrem schnell wieder. Ihre Zahlen erreichten rasch das Niveau von vor der Eliminierung. Stieg dann auch die LASV-Prävalenz im selben Maße wieder an? Ist also eine regelmäßige, zum Beispiel jährliche Nagetierbekämpfung gar nicht nachhaltig? Mathematische Modell-Simulationen legten dies nahe.
Lassafieberbekämpfung: Bisher vor allem Nagetierbekämpfung

Sie kamen auch zu dem Schluss, dass eine kontinuierliche Dichtekontrolle ein effizienteres Mittel sein könnte, um LASV in den Dörfern zu beseitigen. Sie ergaben beispielsweise, dass das LASV innerhalb von vier Jahren ausgerottet ist, wenn die Nagepopulation dauerhaft um 60 Prozent reduziert wird.
Das wollten die Forschenden genauer wissen. In einem der Dörfer, in Brissa, führten sie ein intensives Fangexperiment durch: eine Kombination aus chemischer Bekämpfung und dem Aufstellen von Fallen. Zehn bis 30 Tage lang verteilten sie einmal im Jahr Rodentizide. Im letzten Jahr stellten sie zusätzlich drei Monate lang in fast allen Häusern intensiv Schnappfallen auf. Vorher und nachher fingen sie Nagetiere, um die Veränderungen im Fangerfolg zu ermitteln. Und sie untersuchten die Tiere auf Lassa-Virus-RNA und IgG-Antikörper.
Beide Maßnahmen zusammen reduzierten die Nagerpopulation um 74 bis 92 Prozent. Allerdings stieg sie wie erwartet kurz nach der Keulung sprunghaft wieder an: Schon nach einem halben Jahr hatte sie ihre ursprüngliche Dichte erreicht. Bei der Infektionsrate der Mäuse gab es aber eine große Überraschung: Die Rodentizide reduzierten die Seroprävalenz wie erwartet um fünf Prozent. Das intensive Fallenstellen führte aber sogar zu einer deutlich höheren Infektionsrate: Die Seroprävalenz stieg von 28 auf 67 Prozent.
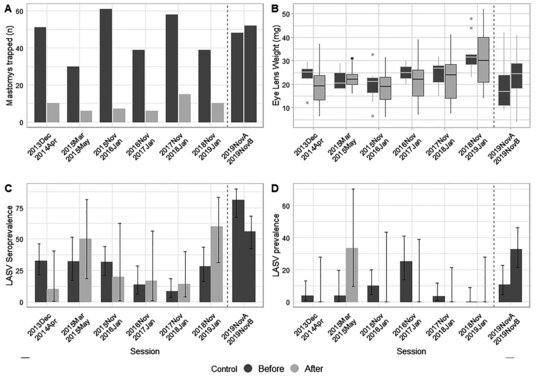
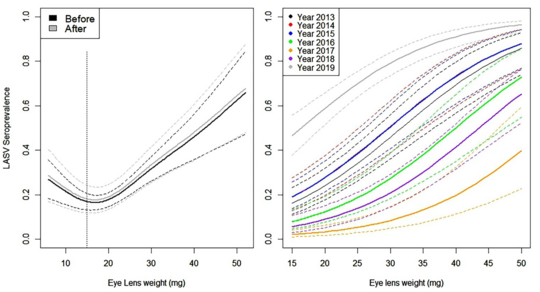
Abb. rechts: Infektionsrate des Lassa-Virus in der Nagerpopulation in Brissa, abgeleitet aus altersspezifischen Seroprävalenzdaten. Links: Darstellung der LASV-Seroprävalenz in Abhängigkeit vom Gewicht der Augenlinsen für die Fangsitzungen 1-6 (2013-2018). Beim Vergleich der Fangsitzungen vor (schwarz) und nach der chemischen Nagerbekämpfung (grau) wurde kein Unterschied in der Infektionsrate festgestellt. Rechts: Es wurden signifikante Unterschiede in der Infektionsrate zwischen den Jahren festgestellt. Die durchgezogenen Linien stellen Schätzungen dar, abgeleitet aus einem verallgemeinerten linearen Modell mit 95 % Konfidenzintervallen (gepunktete Linien).
Abb. links: A) Anzahl der Mastomys natalensis, die vor und nach der Rodentizid-Behandlung pro 3-Nächte-Fangaktion in Brissa gefangen wurden. B) Boxplots zur Veranschaulichung der Verteilung der Augenlinsengewichte bei gefangenen Mastomys natalensis (ein bekannter Näherungswert für das Alter bei Säugetieren), kategorisiert nach Fangsitzungen vor und nach der Rodentizidbehandlung. C) Lassa-Seroprävalenz (IgG) während des Fallenstellens vor und nach der Rodentizidbehandlung. D) Lassa-Prävalenz (PCR) nach Fangdurchgang, sowohl vor als auch nach der Rodentizid-Behandlung. In Dunkelgrau die Sitzungen vor der Rodentizidbehandlung und in hellgrau die Sitzungen danach. Die gestrichelten Linien kennzeichnen die intensive Fangserie, die zwischen dem 17.02.2019 und dem 15.05.2019 stattfand.
Das Autorenteam erklärt diese Ergebnisse zum einen mit der oben geschilderten Fruchtbarkeit der Vielzitzenmäuse: Offenbar gelang es ihnen, den Rückgang ihrer Populationsdichte extrem schnell zu kompensieren, besonders nach der chemischen Bekämpfung. Dies könne damit zusammenhängen, dass ältere Tiere ihre Lieblingsnahrungsquellen haben, also weniger chemische Köder aufnahmen: Die Population alterte, die überlebenden Tiere waren bereits fortpflanzungsfähig und glichen die erheblichen Verluste in der jüngeren Generation schnell aus. Gleichzeitig waren sie bereits chronisch Lassa-infiziert: die Seroprävalenz stieg.

Das Forschungsteam kommt deshalb zu dem Schluss, dass die jährliche chemische Kontrolle von Vielzitzenmäusen allein oder zusammen mit Fallen unwirksam oder sogar kontraproduktiv ist.
Die Leiterin der Studie und Letztautorin des Papers Dr. Elisabeth Fichet-Calvet: „Nach so vielen Jahren intensiver Experimente und Beobachtung haben wir erhebliche Zweifel, ob die Nagetierbekämpfung überhaupt geeignet ist, Lassafieber zu bekämpfen. In den Gegenden, in denen wir geforscht haben, zirkuliert das Virus zudem in einem Maße, dass die Immunität der Bevölkerung sehr hoch ist und es selten zu schweren Verläufen kommt.“ Anders sehe es in Städten aus, in denen die Mobilität der Bevölkerung höher sei und das Virus häufiger auf nicht immune Menschen treffe.
Insgesamt könne es sinnvoller und auch kosteneffizienter sein, das ganze Jahr über Schnappfallen aufzustellen und/oder Köder mit Hormonen auszulegen, um die Fruchtbarkeit der Nager zu kontrollieren.
Originalpublikation
Mariën, J. et al. (2024). Rodent control strategies and Lassa virus: some unexpected effects in Guinea, West Africa. Emerging Microbes & Infections, 13(1). https://doi.org/10.1080/22221751.2024.2341141
Über das Bernhard-Nocht-Institut für Tropenmedizin (BNITM)
Das Bernhard-Nocht-Institut für Tropenmedizin (BNITM) ist Deutschlands größte Einrichtung für Forschung, Versorgung und Lehre auf dem Gebiet tropentypischer und neu auftretender Infektionskrankheiten. Seit jeher werden BNITM-Forschungsschwerpunkte unter dem Aspekt der Globalen Gesundheit / One Health betrachtet sowie unter dem Aspekt der Translation – des Transfers von Grundlagenforschung in die Anwendung. Dieser Forschungsansatz spiegelt sich auch in den fünf Sektionen des Instituts wider: Pathogen (Erreger) -> Interface (Immunologie, Wirt/Erreger) -> Patient (Klinik) -> Population (Epidemiologie) -> Implementation (erfolgreiche Anwendung Etablierung des Wissens).
Aktuelle thematische Schwerpunkte bilden Malaria, hämorrhagische Fieberviren, vernachlässigte Tropenerkrankungen (NTDs), Immunologie, Epidemiologie und die Klinik tropischer Infektionen sowie die Mechanismen der Übertragung von Viren durch Stechmücken. Für den Umgang mit hochpathogenen Viren und infizierten Insekten verfügt das Institut über Laboratorien der höchsten biologischen Sicherheitsstufe (BSL4) und ein Sicherheits-Insektarium (BSL3). Die mobilen Laboratorien des BNITM stehen für die globale Ausbruchsbekämpfung hochpathogener oder hochinfektiöser Viren bereit.
Das BNITM ist Nationales Referenzzentrum für den Nachweis aller tropischen Infektionserreger, WHO-Kooperationszentrum für Arboviren und hämorrhagische Fieberviren, WHO-Kooperationszentrum für Verhaltensforschung zur Förderung Globaler Gesundheit und ein Institut in der Leibniz-Gemeinschaft.
Gemeinsam mit dem ghanaischen Gesundheitsministerium und der Universität von Kumasi betreibt das BNITM ein modernes Forschungs- und Ausbildungszentrum im westafrikanischen Regenwald, das auch externen Arbeitsgruppen zur Verfügung steht. Darüber hinaus pflegt das Institut zahlreiche weitere Kooperationen unter anderem in anderen afrikanischen Ländern wie in Gabun, Nigeria, Tansania und Madagaskar.
Ansprechperson
Ph.D. Elisabeth Fichet-Calvet
Telefon : +49 40 285380-942
E-Mail : fichet-calvet@bnitm.de
Julia Rauner
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-264
E-Mail : presse@bnitm.de
Weiterführende Informationen






