Röntgenlichtquelle PETRA III identifiziert vielversprechende Kandidaten für Coronamedikamente
Gemeinsames Großprojekt im Kampf gegen SARS-CoV-2
Hamburg. An der hochbrillanten Röntgenlichtquelle PETRA III des Deutschen Elektronen-Synchrotons (DESY) hat ein Forschungsteam, in dem auch das Bernhard-Nocht-Instituts für Tropenmedizin (BNITM) aktiv ist, mehrere Kandidaten für Wirkstoffe gegen das Coronavirus SARS-CoV-2 identifiziert. Die vielversprechenden Wirkstoffkandidaten binden an ein wichtiges Protein des Virus und könnten damit die Basis für ein Medikament gegen COVID-19 sein.
In einem sogenannten Röntgenscreening testeten die Forscherinnen und Forscher unter der Federführung von DESY in kurzer Zeit fast 6.000 bereits für die Behandlung anderer Krankheiten existierende Wirkstoffe. Nach der Messung von rund 7.000 Proben konnte das Team insgesamt 37 Stoffe identifizieren, die an die Hauptprotease (Mpro) des SARS-CoV-2-Virus binden, wie die Wissenschaftlerinnen und Wissenschaftler heute im renommierten Fachmagazin „Science“ online berichten. Sieben dieser Stoffe wiederum hemmen die Aktivität der Hauptprotease und bremsen so die Vermehrung des Virus, wie das BNITM herausfand. Zwei von ihnen sind so vielversprechend, dass sie zurzeit in präklinischen Studien weiter untersucht werden. Das vermutlich größte Wirkstoffscreening dieser Art brachte zudem eine neue Bindungsstelle an der Hauptprotease des Virus zu Tage, an der Medikamente ankoppeln können.

Im Gegensatz zu Impfstoffen, die gesunden Menschen helfen, sich gegen das Virus wehren zu können, werden in der Wirkstoffforschung Medikamente gesucht, die bei erkrankten Personen die Vermehrung des Virus im Körper bremsen oder zum Erliegen bringen. Viren können sich allein nicht vermehren. Sie schleusen stattdessen ihr eigenes Erbgut in die Zellen ihres Wirts ein und bringen diese dazu, neue Viren herzustellen. Dabei spielen Proteine wie die Hauptprotease des Virus eine wichtige Rolle. Sie zerschneidet Proteinketten, die nach dem Bauplan des Viruserbguts von der Wirtszelle hergestellt wurden, in kleinere Teile, die für die Vermehrung des Virus notwendig sind. Gelingt es, die Hauptprotease zu blockieren, lässt sich der Zyklus unter Umständen unterbrechen; das Virus kann sich nicht mehr vermehren, und die Infektion kommt zum Erliegen.
Hightech in der Strukturbiologie – von tausenden Kandidaten auf die besten zwei
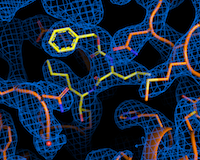
Die Strahlführung P11 von DESYs Forschungslichtquelle PETRA III ist auf strukturbiologische Untersuchungen spezialisiert. Hier lassen sich die dreidimensionale räumliche Struktur von Proteinen atomgenau darstellen. Das nutzte das Forschungsteam um DESY-Physiker Alke Meents, um mehrere tausend bekannte Wirkstoffe aus einer Bibliothek des Fraunhofer-Instituts für Translationale Medizin und Pharmakologie und einer weiteren der italienischen Firma Dompé Farmaceutici SpA darauf zu untersuchen, ob und wie sie an die Hauptprotease „andocken“ – der erste wichtige Schritt, um sie zu blockieren. Wie der Schlüssel in ein Schloss passt dabei das Wirkstoffmolekül in ein Bindungszentrum der Protease. Der Vorteil der Wirkstoffbibliothek: Es handelt sich um bereits für die Behandlung von Menschen zugelassene Wirkstoffe oder solche, die sich zurzeit in verschiedenen Erprobungsphasen befinden. Geeignete Kandidaten zur Bekämpfung von SARS-CoV-2 könnten daher erheblich schneller in klinischen Studien eingesetzt werden und so Monate oder Jahre der Wirkstoffentwicklung sparen.
Die technische Spezialausrüstung an der PETRA III-Station P11 beinhaltet einen vollautomatischen Probenwechsel mit einem Roboterarm, so dass jede der über 7.000 Messungen nur etwa drei Minuten dauerte. Mit Hilfe einer automatisierten Datenanalyse konnte das Team schnell die Spreu vom Weizen trennen. „Mit Hilfe eines Hochdurchsatzverfahrens haben wir insgesamt 37 Wirkstoffe finden können, die eine Bindung mit der Hauptprotease eingehen“, sagt Meents, der die Experimente initiierte.
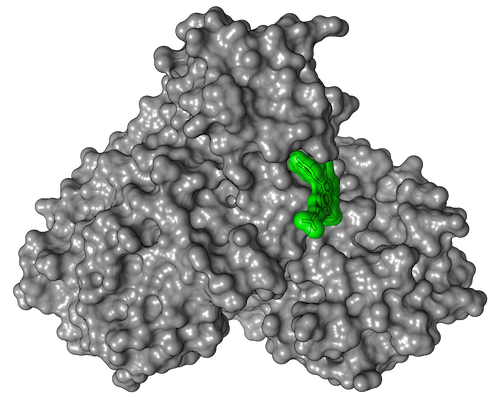
In einem nächsten Schritt untersuchte die Forschungsgruppe um Yaiza Fernández-García von der Abteilung Virologie am BNITM, ob diese Wirkstoffe in Zellkulturen die Virusvermehrung hemmen oder gar verhindern, und wie verträglich sie für die Wirtszellen sind. Hierbei reduzierte sich die Zahl der geeigneten Wirkstoffe auf sieben, von denen zwei besonders hervorstachen. Die Wirkstoffe Calpeptin und Pelitinib zeigten die deutlich höchste antivirale Aktivität bei guter Zellverträglichkeit. Daher haben Kooperationspartner bereits präklinische Untersuchungen mit diesen beiden Wirkstoffen begonnen.
Neue Bindungsstelle identifiziert
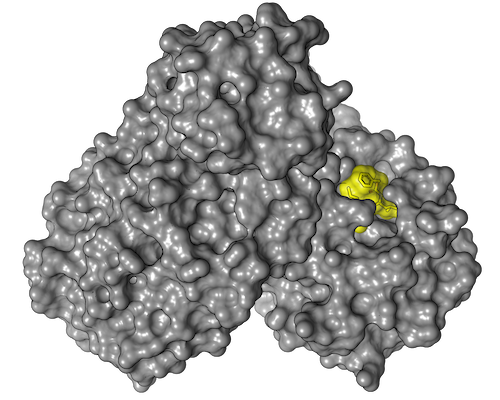
In ihrem Wirkstoffscreening mit Hilfe der Proteinkristallographie untersuchten die Forschenden nicht wie üblich Fragmente potenzieller Wirkstoffe, sondern vollständige Wirkstoffmoleküle. Dabei entdeckte das Team aus mehr als 100 Wissenschaftlerinnen und Wissenschaftlern auch etwas komplett Unerwartetes: Es fand eine Bindungsstelle an der Hauptprotease, die bis dahin noch völlig unbekannt war. „Es war nicht nur eine positive Überraschung, dass wir eine neue Bindungsstelle für Medikamente an der Hauptprotease entdecken konnten – ein Ergebnis, das man wirklich nur an einer Synchrotronlichtquelle wie PETRA III erzielen kann –, sondern dass sogar einer der beiden heißen Wirkstoffkandidaten genau an diese Stelle bindet“, sagt Christian Betzel von der Universität Hamburg, Mitinitiator der Studie.
Eine besondere Stärke der Methode des Röntgenscreenings im Vergleich zu anderen Screeningmethoden ist, dass Forschende als Ergebnis die dreidimensionale Struktur der Protein-Wirkstoff-Komplexe erhalten und damit die Bindung der Wirkstoffe an das Protein auf atomarer Ebene bestimmen können. Selbst wenn die beiden aussichtsreichsten Kandidaten es nicht in klinische Studien schaffen sollten, so bilden die 37 Stoffe, die an die Hauptprotease binden, eine zentrale Datenbasis für darauf aufbauende Medikamentenentwicklungen.
Originalpublikation: X-ray screening identifies active site and allosteric inhibitors of SARS-CoV-2 main protease; Sebastian Günther, Patrick Y. A. Reinke, et al.; „Science“, 2021; DOI: 10.1126/science.abf7945
Offizielle Pressemitteilung: DESY News 02.04.2021
Die Kooperationspartner: An den Arbeiten sind neben DESY- und BNITM-Wissenschaftlerinnen und -Wissenschaftlern auch Forschende der Universitäten Hamburg und Lübeck, des Fraunhofer-Instituts für Translationale Medizin und Pharmakologie, des Heinrich-Pette-Instituts, des European XFEL, des Europäischen Laboratoriums für Molekularbiologie EMBL, der Max-Planck-Gesellschaft, des Helmholtz-Zentrums Berlin und weiteren Institutionen beteiligt. Zusätzlich zu den Experimenten an der Messstation P11 wurden auch Messungen an den EMBL-Messstationen P13 und P14 an PETRA III durchgeführt.
Ansprechperson
Ph.D. Yaiza Fernández García
Research Group Leader
Telefon : +49 40 285380-942
E-Mail : yaiza.fernández-garcía@bnitm.de
Prof. Dr. Stephan Günther
Leitung Abteilung Virologie
Telefon : +49 40 285380-547
Fax : +49 40 285380-459
E-Mail : guenther@bnitm.de
Dr. Eleonora Schönherr
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-269
E-Mail : presse@bnitm.de
Julia Rauner
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-264
E-Mail : presse@bnitm.de






