Proteine im Blutplasma von Malariaerkrankten setzen Entzündungsprozesse in Gang
In einer Studie zum Malariaparasiten Plasmodium falciparum hat die Forschungsgruppe um Prof. Iris Bruchhaus vom Bernhard-Nocht-Institut für Tropenmedizin (BNITM) erstmals nachgewiesen, dass auch Proteine im Blutplasma von Malariapatientinnen und -patienten die Produktion von Entzündungsbotenstoffen beeinflussen. Bisher gingen Forschungsgruppen davon aus, dass diese Botenstoffe nur dann ausgeschüttet werden, wenn infizierte rote Blutkörperchen sich an die Wände von Blutgefäßen anheften. Die Forschungsarbeiten wurden im Juli 2021 im Journal Cells publiziert.
Die Malaria ist die bedeutendste Tropenerkrankung, der weltweit jährlich etwa 400.000 Menschen zum Opfer fallen. Der überwiegende Teil der Todesfälle ist nach einer Infektion mit Plasmodium falciparum in Afrika zu beklagen. Dieser Parasit erzeugt die besonders schweren Infektionen, indem er rote Blutkörperchen befällt und die infizierten roten Blutkörperchen schließlich an die Wände von Blutgefäßen binden. Die Bindung führt zu einer Verstopfung kleiner Blutgefäße, Sauerstoffunterversorgung und Aktivierung des Immunsystems. Dadurch bedingt kann es zu Organversagen und auch zu einer Schädigung des Gehirns (Cerebrale Malaria) kommen.
Die Aktivierung des Immunsystems ist gekennzeichnet durch eine erhöhte Konzentration an unterschiedlichen Botenstoffen (Zytokinen) im Blut von Malariaerkrankten. Insbesondere die Zellen der Blutgefäße, die sogenannten Endothelzellen, sind eine potenzielle Quelle dieser Zytokine. Bisher wurden mehr als 30 verschiedene Zytokine in erhöhten Konzentrationen im Plasma von Malariapatienten nachgewiesen. Es war bisher nicht bekannt, ob die Ausschüttung dieser Botenstoffe nur durch den direkten Kontakt der mit P. falciparum infizierten roten Blutkörperchen mit den Endothelzellen oder auch kontaktunabhängig angeregt werden kann.
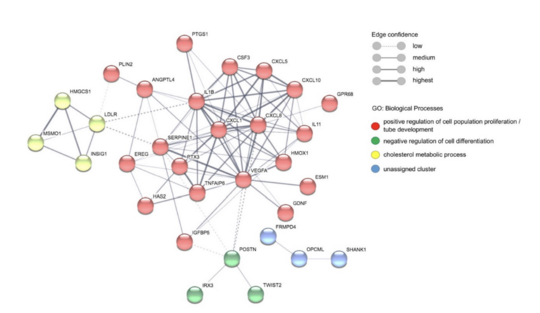
Die Arbeitsgruppe Bruchhaus wies nach, dass mit Plasma von Malariaerkrankten versetzte Endothelzellen verschiedene Zytokine und Wachstumsfaktoren ausschütten. In einer parallel durchgeführten Studie hat das Team untersucht, welche RNA-Moleküle durch das Versetzen mit Patientenplasma von Endothelzellen erzeugt werden. Diese sogenannte Transkriptomanalyse bestätigte die oben beschriebenen Ergebnisse der gesteigerten Produktion verschiedener Zytokine. Damit konnte die Forschungsgruppe zeigen, dass nicht nur die direkte Bindung von infizierten roten Blutkörperchen, sondern auch Moleküle im Plasma von Malariapatient:innen die Endothelzellen der Blutgefäße beeinflussen. Dies betrifft nicht nur die immunologische Antwort, sondern auch andere Prozesse wie Zellvermehrung und die Ausbildung von Blutgefäßen.
Hintergrund
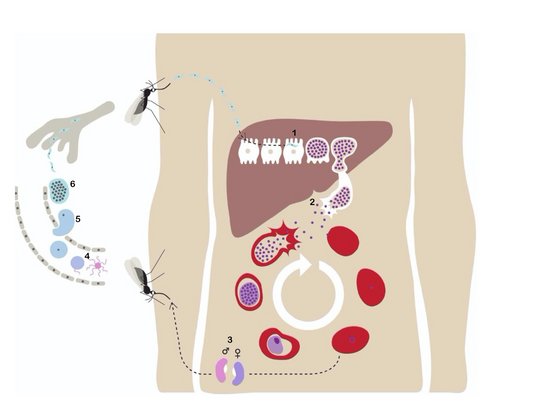
Der Malariaerreger P. falciparum ist ein Parasit und wird durch den Stich einer infizierten weiblichen Anopheles-Mücke auf den Menschen übertragen. Die Parasiten in Form von Sporozoiten (1) wandern in die menschliche Leber und vermehren sich dort ungeschlechtlich und verursachen keine Symptome. Die Parasiten werden in Form von Merozoiten (2) im Anschluss in den Blutkreislauf freigesetzt, dringen in die roten Blutkörperchen ein und vermehren sich erneut. Nach dem Aufplatzen der roten Blutkörperchen dringen sie in weitere rote Blutkörperchen ein. Dieser Zyklus wiederholt sich und verursacht immer dann eine Fieberantwort, wenn die Parasiten ausbrechen und erneut in die Blutkörperchen eindringen. Einige der Merozoiten entwickeln sich zu sexuellen Formen des Parasiten, den so genannten Gametozyten (3), die im Blutkreislauf zirkulieren. Wenn eine Stechmücke einen infizierten Menschen sticht, nimmt sie die Gametozyten auf, die sich zu reifen Geschlechtszellen, den Gameten (4), weiterentwickeln. Die befruchteten (5) weiblichen Gameten entwickeln sich zu Oozysten (6), in denen Tausende von Sporozoiten heranreifen. Die Oozysten platzen schließlich und setzten Sporozoiten frei, die zu den Speicheldrüsen der Mücke wandern. Wird dann ein Mensch gestochen, schließt sich der Kreislauf.
Trotz der Fortschritte bei den Malariakontrollprogrammen ist Malaria nach wie vor eine der verheerendsten Infektionskrankheiten weltweit. Von den fünf Arten, die Malaria beim Menschen verursachen, ist Plasmodium falciparum die klinisch bedeutendste Art und verantwortlich für die meisten Todesfälle. Im Jahr 2019 litten 229 Millionen Menschen an Malaria, rund 409.000 Menschen starben daran. Die Coronavirus-Pandemie hat diesen Zustand weiter verschlechtert, da Programme zur Mückenkontrolle vielerorts nicht mehr durchgeführt werden konnten.
Über das Bernhard-Nocht-Institut für Tropenmedizin
Das Bernhard-Nocht-Institut für Tropenmedizin (BNITM) ist ein Institut der Leibniz-Gemeinschaft und Deutschlands größte Einrichtung für Forschung, Versorgung und Lehre auf dem Gebiet tropentypischer und neu auftretender Infektionskrankheiten. Aktuelle Forschungsschwerpunkte bilden Malaria, hämorrhagische Fieberviren, Immunologie, Epidemiologie und Klinik tropischer Infektionen sowie die Mechanismen der Übertragung von Viren durch Stechmücken. Für den Umgang mit hochpathogenen Viren und infizierten Insekten verfügt das Institut über Laboratorien der höchsten biologischen Sicherheitsstufe (BSL4) und ein Sicherheits-Insektarium (BSL3). Das BNITM umfasst das nationale Referenzzentrum für den Nachweis aller tropischen Infektionserreger und das WHO-Kooperationszentrum für Arboviren und hämorrhagische Fieberviren. Gemeinsam mit dem ghanaischen Gesundheitsministerium und der Universität von Kumasi betreibt es ein modernes Forschungs- und Ausbildungszentrum im westafrikanischen Regenwald, das auch externen Arbeitsgruppen zur Verfügung steht.
Ansprechperson
Prof. Dr. Iris Bruchhaus
Research Group Leader
Telefon : +49 40 285380-472
E-Mail : bruchhaus@bnitm.de
Dr. Eleonora Schönherr
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-269
E-Mail : presse@bnitm.de






