Vielversprechende virale Zielstrukturen für ein Breitband-Virostatikum
Vermehrungsmaschinerie des Fiebervirus SFTSV bis ins kleinste Detail analysiert
Die BMBF-Nachwuchsgruppe um Dr. Maria Rosenthal am Bernhard-Nocht-Institut für Tropenmedizin (BNITM) hat neue Erkenntnisse zu einem wichtigen Protein in der Vermehrungsmaschinerie des Fieber-Thrombozytopenie-Virus SFTSV, einem Bunyavirus, gewonnen. Gemeinsam mit Kooperationspartnern und mithilfe modernster Kryo-Elektronenmikroskopie hat die Gruppe die Molekülstrukturen in fünf verschiedenen funktionellen Zuständen bis in die Details sichtbar gemacht. Das untersuchte Protein ist für die Virusvermehrung von Bunyaviren notwendig und bietet so hervorragende Angriffspunkte für antivirale Wirkstoffe. Die Ergebnisse des von der Leibniz-Gemeinschaft geförderten Projekts sind in der Fachzeitschrift Nucleic Acids Research erschienen: doi: 10.1093/nar/gkac1249.
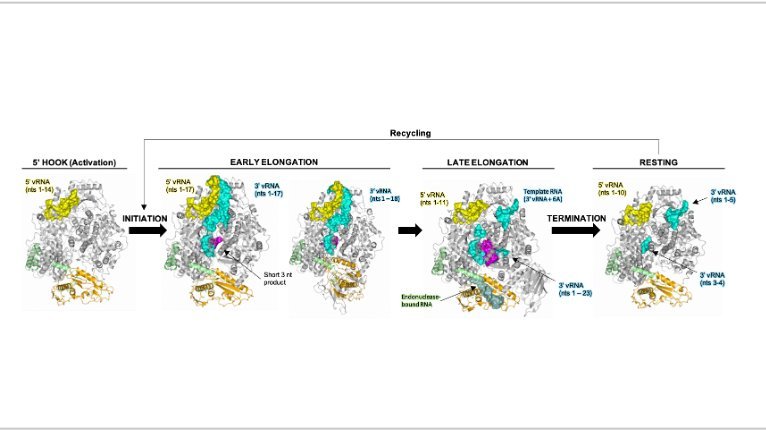
Bild: Der Prozess der viralen Genomvervielfältigung durch das SFTSV L-Protein wurde an unterschiedlichen Stellen gestoppt und die 3D-Struktur und Bindung der viralen RNA bis ins Detail analysiert. Das L-Protein ist als Bändermodell in Grau gezeigt, die unterschiedlichen RNA-Spezies sind in verschiedenen Farben dargestellt. Die einzelnen Schritte des Prozesses der Genomvervielfältigung sind beschriftet. Die gewonnenen Daten erlauben ein mechanistisches Verständnis des Prozesses und eine Identifizierung von wichtigen Angrffspunkten für antivirale Medikamente.
Globalisierung, Klimawandel, die Nähe zu Wildtieren und die steigende Zahl resistenter Erreger erhöhen das Risiko für die globale Ausbreitung von Infektionskrankheiten. Neue Einschleppungen von Arboviren (durch Insekten übertragene Viren) wie West-Nil-Virusinfektionen in Deutschland beobachten Forschungsgruppen zunehmend auch in der Bevölkerung Zentraleuropas.
Das SFTS-Virus (SFTSV) ist ein Virus mit segmentierter Einzelstrang-RNA. Überträger sind Schildzecken – somit gehört das Virus zu den Arboviren. In Ostasien hat sich das SFTS-Virus schnell ausbreiten können und ist dort mittlerweile endemisch. Ein SFTS-Virusinfekt kann das sogenannte „Schweres-Fieber-mit-Thrombozytopenie-Syndrom“auslösen. Typische Symptome sind ein hohes Fieber, Müdigkeit sowie ein Defizit an weißen Blutkörperchen (Leukopenie) und Blutplättchen (Thrombozytopenie) bis hin zu Multiorganversagen.
Die potenzielle Gefahr für die Bevölkerung, beispielsweise durch Bunyavirus-Epidemien, wird von der Weltgesundheitsorganisation (WHO) hervorgehoben und im WHO-Forschungs- und Entwicklungsplan verdeutlicht. In Europa zugelassene Impfstoffe oder wirksame Medikamente gegen Bunyavirus-Infektionen gibt es bisher nicht.
„Umso wichtiger, dass wir die Vermehrungsmaschinerie der unterschiedlichen Bunyaviren bis ins kleinste Detail erforschen und verstehen lernen“, sagt die Nachwuchsgruppenleiterin Rosenthal.

Regulierung der Virus-Vermehrungsmaschinerie unter die Lupe genommen
Das Forschungsteam aus internationalen Wissenschaftlerinnen und Wissenschaftlern mehrerer Institute hat nun eines der wichtigsten Bausteine der Vermehrungsmaschinerie des SFTS-Virus bis in den Nanometer-Bereich analysiert, das sogenannte L-Protein des für das Virus essentiellen Enzyms RNA-Polymerase.
Die Zusammenarbeit zwischen Forschungsgruppen des BNITM mit dem EMBL* Grenoble und den Labors von LIV / UHH** am Centre for Structural Systems Biology (CSSB) führte zu der gemeinsamen Entdeckung, wie das SFTSV L-Protein auf molekularer Ebene aktiv ist und reguliert wird. Das L-Protein verändert beispielsweise seine Form, wenn ein bestimmter RNA-Haken sich wie ein Schlüssel in die entsprechende Stelle (Schloss) des L-Proteins einfügt. Auch weitere wichtige Bindungsstellen für RNA wurden in dem L-Protein identifiziert. Die Forschungsgruppen konnten außerdem erstmals beobachten, wie ungenau die virale Polymerase beim Kopieren der RNA ist, wie also Mutationen entstehen.
„Es gibt mehrere Stellen in der L-Proteinstruktur, die essenziell für die unterschiedlichen Funktionen des Proteins sind und vermutlich durch Medikamentenwirkstoffe blockiert werden können. Man kann sich das wie lauter kleine Schlösser vorstellen, die in der richtigen Reihenfolge aufgeschlossen werden müssen. Die Blockierung eines dieser Schlösser wirkt dann hemmend auf die Aktivität der RNA-Polymerase und stoppt die Virusvermehrung“, erklärt Rosenthal.
Translation in der Infektionsforschung: Grundlagen schaffen für die Anwendung
Schon in der Vergangenheit hat Rosenthal Ergebnisse in der Strukturforschung für die Lassavirus-Polymerase veröffentlicht und dabei verschiedene funktionelle Zustände beschrieben (Nature Communications, 2021; DOI 10.1038/s41467-021-27305). Obwohl Lassa- und SFTS-Viren sich in vielerlei Hinsicht deutlich unterscheiden, sind sie doch genetisch nah verwandt und ihre Polymerasen – die Vermehrungsmaschinerie – zeigen Ähnlichkeiten.
„Wir hoffen, dass diese Ähnlichkeiten zwischen den Viren es ermöglichen, eine Art Breitspektrum-Virostatikum zu entwickeln, das gegen alle diese Viren wirksam ist“, so Rosenthal. „Die Strukturbiologie ist wichtig, um im Detail zu verstehen, wie diese Viren funktionieren“, setzt sie fort. „Mit diesem Wissen entwickeln wir Strategien, die zukünftig eine Behandlung von durch Bunyaviren bedingte Erkrankungen ermöglichen könnten.“
In einem hochkompetitiven Wettbewerb hatte die junge Wissenschaftlerin aus der Abteilung Virologie des BNITM im Jahr 2020 mehr als zwei Millionen Euro vom Bundesministerium für Bildung und Forschung (BMBF) für genau diesen Forschungsansatz in der Strukturbiologie erhalten.
„Die ersten Erfolge einer langfristigen lokalen und europäischen Forschungskooperation stellen sich nun ein. Wir sind überzeugt, dass die Ergebnisse neue Möglichkeiten für zukünftige antivirale Therapien für Lassa-Fieber eröffnen werden“, sagt Prof. Stephan Günther, Vorstandsmitglied und Leiter der Abteilung Virologie am BNITM.
5.273 Zeichen (inklusive Leerzeichen)
* European Molecular Biology Laboratory
** Leibniz-Institut für Experimentelle Virologie (LIV) / Universität Hamburg (UHH) mit Laboren am Centre for Structural Systems Biology (CSSB)
Originalpublikation:
Williams H.M., Thorkelsson S. R., et al.; Structural insights into viral genome replication by the severe fever with thrombocytopenia syndrome virus L protein. Nucleic Acids Research, 1-19, 2022: https://doi.org/10.1093/nar/gkac1249
Hintergrundinformationen:
Funktion der viralen Polymerase in der Virusvermehrung
Um den komplizierten Mechanismus der Virusvermehrung zu verstehen, konzentriert sich die Strukturbiologie auf eine Schlüsselkomponente: die virale Polymerase. In einer infizierten Zelle sorgt dieses Enzym dafür, dass neue Virusbausteine entstehen und vervielfältigt die genetische Information des Virus. Die Genomkopien werden dann mit den Virusbausteinen in neue „Virionen“ verpackt, die die Zelle verlassen und einen neuen Wirt infizieren können. Die Bestimmung der Polymerasestruktur hilft der Wissenschaft zu verstehen, wie sich ein Virus vermehrt. Und diese Information wiederum gibt den Forschenden wichtige Hinweise für die Entwicklung von Medikamenten, die die Infektion stoppen können.
Partner mit starker Expertise in der Elektronenmikroskopie sind Dr. Emmanuelle Quemin, Gruppenleiterin am Institute for Integrative Biology of the Cell (I2BC), Frankreich, sowie Prof. Kay Grünewald vom LIV / UHH mit Laboren am CSSB in Hamburg. Die Forschungsgruppe um Dr. Stephen Cusack, Leiter des EMBL Grenoble, konzentriert sich auf die Polymerase verschiedener humanpathogener Viren, insbesondere aus der Gruppe der Influenzaviren.
Gefördert von der Leibniz-Gemeinschaft „Leibniz-Wettbewerb“ (Kooperative-Exzellenz)
Im Leibniz-Wettbewerb werden die strategischen Ziele der Leibniz-Gemeinschaft im Rahmen des Paktes für Forschung und Innovation adressiert. Die Maßnahmen motivieren, Forschung und Forschungsinfrastrukturen auf höchstem Niveau zu betreiben und die resultierenden Erfolge sichtbar zu machen. Mit seinen zeitlich befristeten Förderungen setzt der Leibniz-Wettbewerb Anreize zur weiteren Profilbildung der Leibniz-Gemeinschaft. Damit grenzt er sich bewusst von Maßnahmen anderer Förderorganisationen und der institutionellen Förderung ab.
Ansprechperson
Dr. Maria Rosenthal
Research Group Leader
Telefon : +49 40 285380-420
E-Mail : rosenthal@bnitm.de
Dr. Eleonora Schönherr
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-269
E-Mail : presse@bnitm.de
Weiterführende Informationen







