Den Malaria-Erreger an der Verdauung packen
Nachwuchsgruppe des BNITM liefert wichtige Erkenntnisse zum Stoffwechsel des Parasiten
Medikamente findet die Forschung häufig, ohne zunächst deren genaue Wirkbedingungen und -mechanismen zu verstehen. Spätestens wenn Resistenzen drohen, ist genau das aber entscheidend. Bei dem Malaria-Medikament Chloroquin dachte man mehr als ein halbes Jahrhundert lang, Voraussetzung für seine Wirksamkeit wäre das saure Milieu im Verdauungs“organ“ des Parasiten. Eine Forschungsgruppe des Bernhard-Nocht-Instituts für Tropenmedizin (BNITM) hat diese Annahme widerlegt und noch weitere überraschende Erkenntnisse über den Proteinkomplex gewonnen, der zur Ansäuerung des parasitären Verdauungs“organs“ dient. Die Ergebnisse sind in dem Fachjournal The Proceedings of the National Academy of Sciences (PNAS) erschienen.
Malaria-Parasiten kapern rote Blutkörperchen, nisten sich darin ein, „fressen“ den roten Blutfarbstoff, wachsen und vermehren sich, bis die Blutzelle platzt und das Spiel von vorn beginnt – die Blutphase.
Viele Malaria-Medikamente wirken, indem sie den Parasiten an seinen eigenen Abbauprodukten sterben lassen, die bei der Verdauung des roten Blutfarbstoffs innerhalb einer angesäuerten Nahrungsvakuole anfallen. Das bekannteste Beispiel hierfür ist Chloroquin. Die Membran der Nahrungsvakuole (Verdauungs“organ“) ist hierbei eine besonders wichtige Schnittstelle. Sie spielt für die natürlichen Stoffwechselprozesse sowie für die Wirkstoffaufnahme eine Schlüsselrolle.
Die BMBF-Nachwuchsgruppe „Molekulare Parasitologie“ am BNITM hat die Stoffwechselprozesse an der Nahrungsvakuolenmembran mit Hilfe unterschiedlicher innovativer Methoden genau analysiert und konnte dabei wichtige offene Fragen klären.
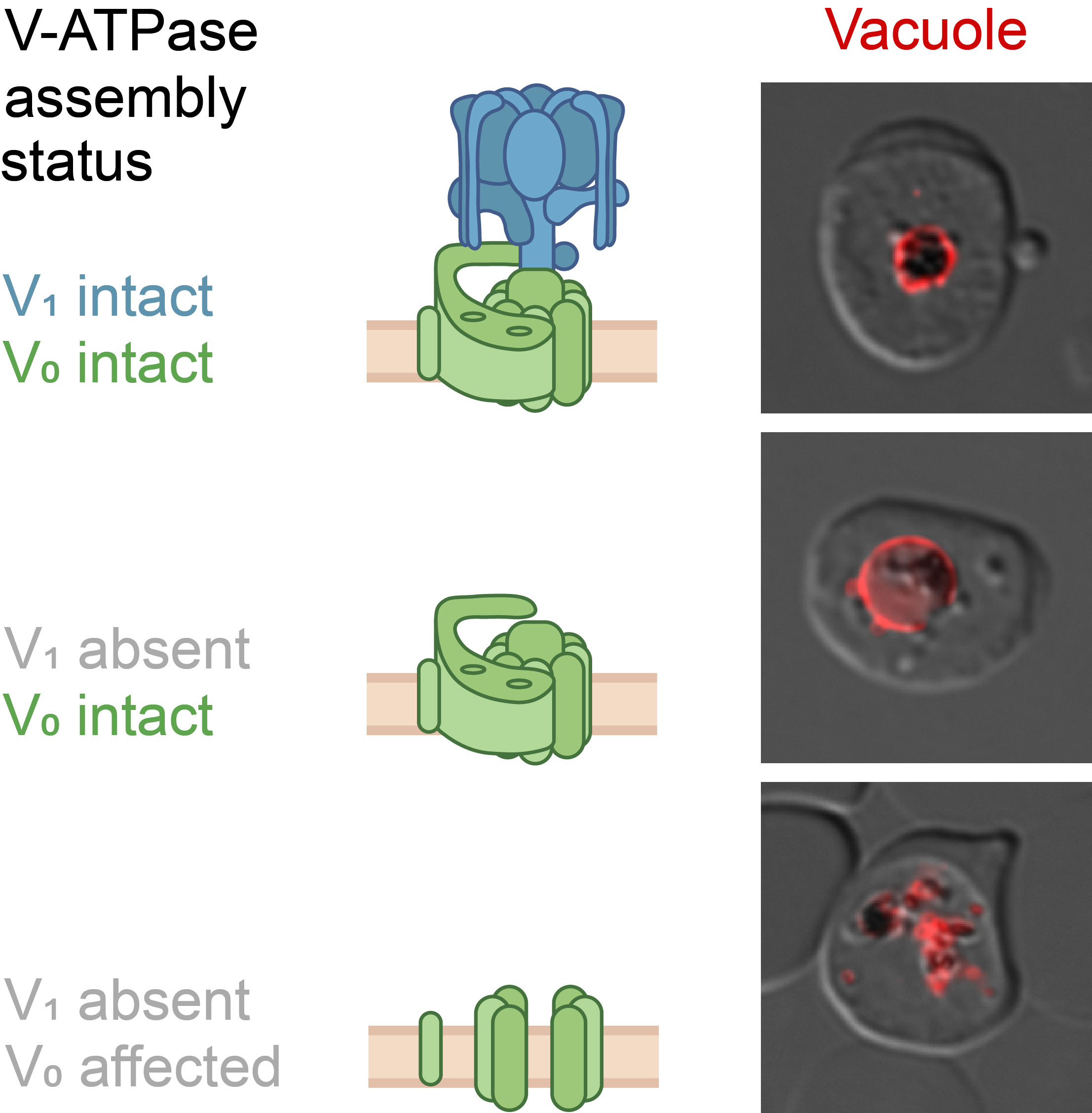
In der Membran der Nahrungsvakuole sitzt zum Beispiel die sogenannte Protonenpumpe, die V-ATPase. Sie pumpt unaufhörlich positiv geladene Protonen aus dem Zellsaft des Parasiten in seine Nahrungsvakuole. Auf diese Weise sorgt sie für ein saures Milieu in diesem Verdauungs“organ“. Das ist – nicht anders als im Magen des Menschen – nötig, um Proteine effizient aufspalten zu können.
Die Forschenden um Dr. Joachim Michael Matz wollten wissen, was passiert, wenn sie Teile der Protonenpumpe ausschalten und so die Ansäuerung der Nahrungsvakuole stören. Dazu nutzten sie eine Kombination verschiedener molekular- und zellbiologischer Methoden wie zum Beispiel CRISPR/Cas9, konditionelle Gendeletionen sowie Fluoreszenz- und Elektronenmikroskopie.
Chloroquin mag’s nicht nur sauer
Die Arbeitshypothese lautete: Wenn der pH-Wert in der Nahrungsvakuole des Malaria-Parasiten steigt, also weniger sauer wird, schwächt dies zum einen den Parasiten bzw. tötet ihn gar ab. Gleichzeitig sammelt sich dort aber auch weniger des Malaria-Medikaments Chloroquin. Denn nach gängiger Lehrmeinung bindet Chloroquin die Protonen, von denen in der Nahrungsvakuole nun weit weniger zur Verfügung standen.
Die erste Annahme wurde bestätigt. Überraschenderweise war aber die Chloroquin-Akkumulation in der Nahrungsvakuole in etwa gleich stark ausgeprägt .
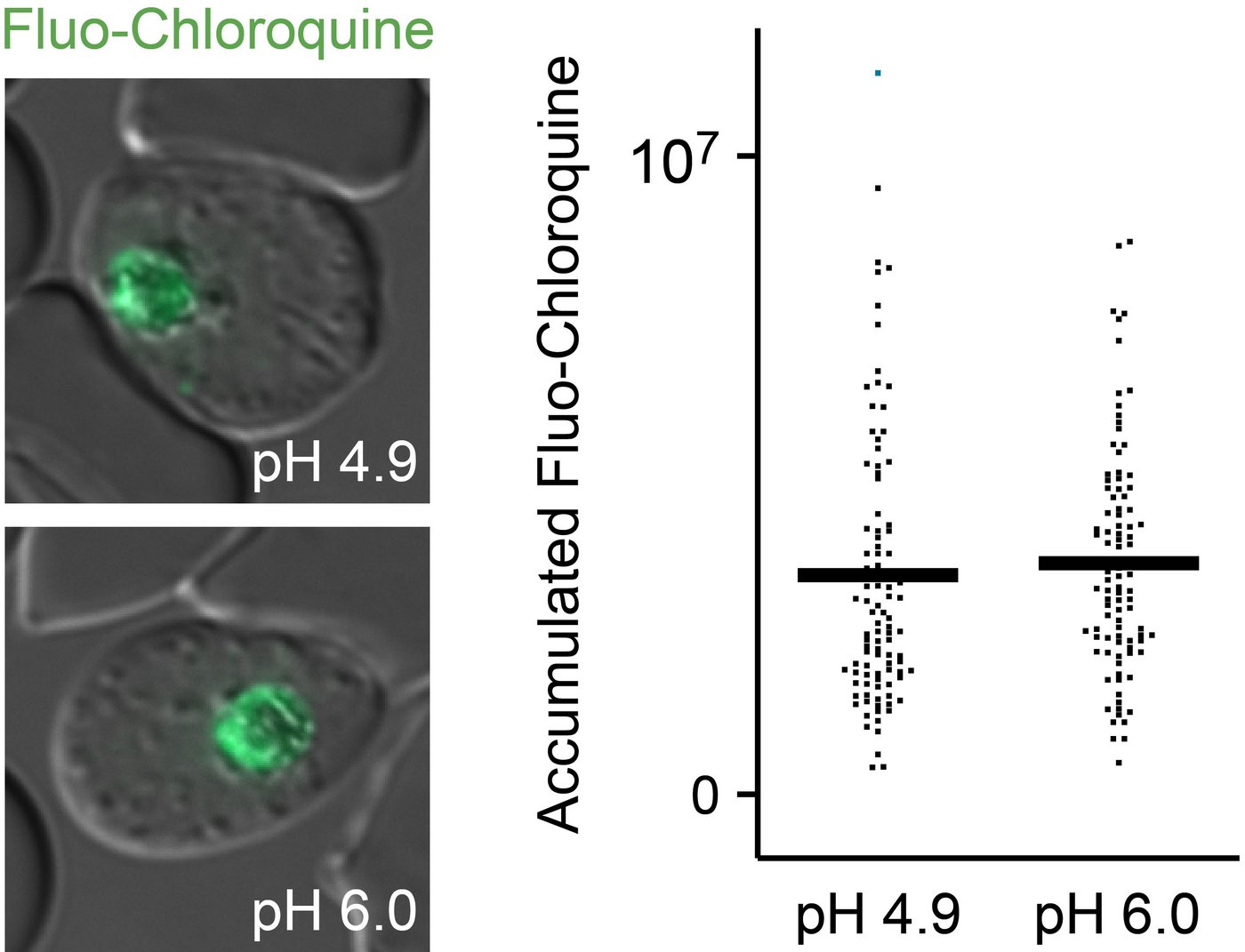
Dies widerspricht diametral der bisherigen Vorstellung vom Aufnahmemechanismus von Chloroquin.
Bisher ging man davon aus, dass Chloroquin-Moleküle an die Protonen in der Nahrungsvakuole des Malaria-Parasiten binden und nun als positiv geladene Teilchen nicht membran-gängig sein würden. Dies solle zur Ansammlung von Chloroquin in der Nahrungsvakuole führen, wo es die Entgiftung der parasiten-eigenen Abbauprodukte hemme.
Doch offenbar führen andere Gründe zur Chloroquin-Ansammlung in der Nahrungsvakuole. Die Arbeitsgruppe von Joachim Matz untersucht derzeit, welche alternativen Transportprozesse dem stattdessen zugrunde liegen könnten, z. B. parasiteneigene Transporter-Proteine. Dies ist auch wichtig für die Entwicklung neuartiger Malaria-Medikamente, die in der Nahrungsvakuole wirken sollen.
Protonenpumpen pumpen nicht nur Protonen
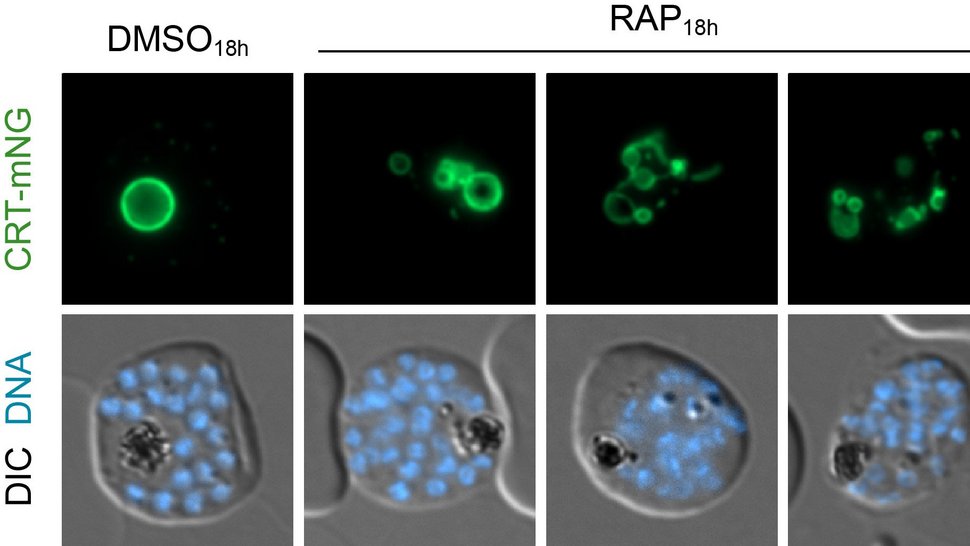
Interessantes Detail der Studie: Es machte bei den Versuchen einen großen Unterschied, ob der Teil der Protonenpumpe manipuliert wurde, der in den Zellsaft ragt oder der Teil, der in der Membran der Nahrungsvakuole liegt. Als die Forschenden nämlich ein Protein innerhalb des Teils in dem Zellsaft ausschalteten, blähte sich die Verdauungsvakuole auf, da der rote Blutfarbstoff nicht mehr effizient abgebaut werden konnte. Als sie aber ein Protein des Teils in der Membran ausschalteten, kollabierte die Verdauungsvakuole und zerfiel in viele Einzelteile. Das heißt, dieser Teil der Protonenpumpe hat offenbar die zusätzliche Funktion, die Verdauungsvakuole des Parasiten zusammenzuhalten.
Der Leiter der BMBF-Forschungsgruppe, Dr. Joachim Michael Matz: „Der biologische Ansäuerungsprozess der Nahrungsvakuole und die molekulare Maschinerie, die ihn steuert, sind noch weitgehend unerforscht. Die Ergebnisse unserer Studie liefern eine Reihe wichtiger Puzzleteile. Sie zeigen unter anderem, dass die Protonenpumpe V-ATPase eine Schlüsselrolle bei der Ansäuerung der Nahrungsvakuole spielt und dass ihre einzelnen Bestandteile offenbar ganz unterschiedliche Funktionen haben“.
Hier will die Forschungsgruppe nun ansetzen und die Funktionen der einzelnen Proteine der Protonenpumpe auf beiden Seiten der Membran der Nahrungsvakuole weiter klären.
Ansprechperson
Dr. Joachim Michael Matz
Research Group Leader
Telefon : +49 40 285380-301
E-Mail : joachim.matz@bnitm.de
Julia Rauner
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-264
E-Mail : presse@bnitm.de
Weiterführende Informationen







