Neue Einblicke in die Zellbiologie der Malaria- und Toxoplasmose-Parasiten
Forschende aus Hamburg und München bündeln ihre Expertise
Wissenschaftler:innen von Bernhard-Nocht-Institut für Tropenmedizin (BNITM) und Ludwig-Maximilians-Universität München (LMU) haben herausgefunden, wie Malaria- und Toxoplasmose-Erreger ihre Zellstrukturen und Transportsysteme aufbauen und organisieren, um zu überleben. Ihre Entdeckungen könnten den Weg für neue Behandlungsmethoden gegen diese weltweit bedeutenden Infektionskrankheiten ebnen. Die Forschungsergebnisse erschienen kürzlich in den Fachzeitschriften Journal of Cell Biology und PLOS Biology.
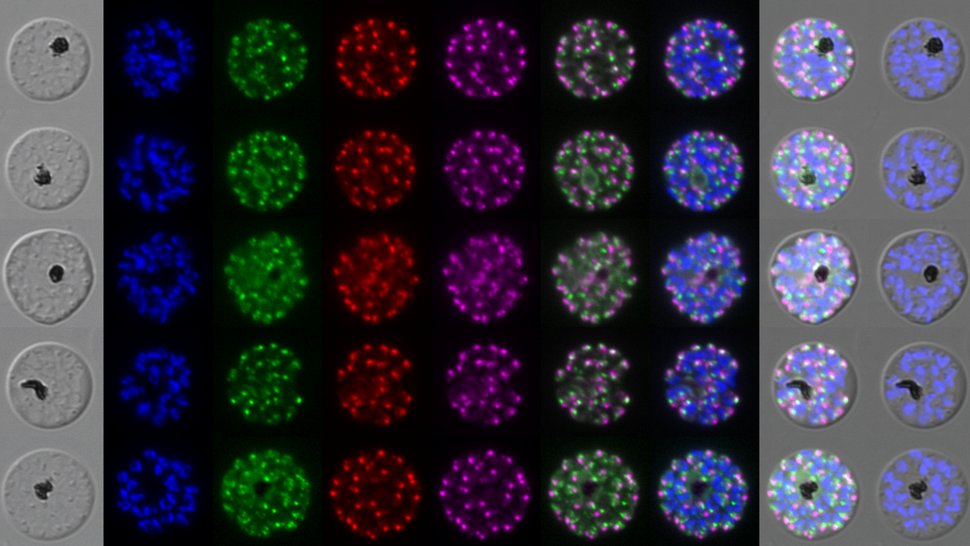
Am BNITM hat sich das Team um Dr. Tobias Spielmann, Leiter der Arbeitsgruppe Malaria-Zellbiologie, zusammen mit der Forschungsgruppe Integrative Parasitologie um Dr. Richárd Bártfai von der Radboud-Universität Nijmegen die Eiweißkomplexe AP-1, AP-3 und AP-4 (Adapterproteine) angeschaut. Sie haben herausgefunden, dass AP-1, AP-3 und AP-4 eine entscheidende Rolle beim Überleben des Malaria-Parasiten spielen. Wie Proteine im Malaria-Parasiten verteilt werden, war bisher wenig verstanden. Die Forschenden konnten nun zeigen: Die Adapter sorgen dafür, dass Proteine in der Zelle an den richtigen Ort gelangen. Beim Malaria-Erreger ist dieser Transportprozess besonders wichtig, da er sowohl für das Eindringen in Wirtszellen als auch für das Wachstum im Inneren der Zellen benötigt wird.
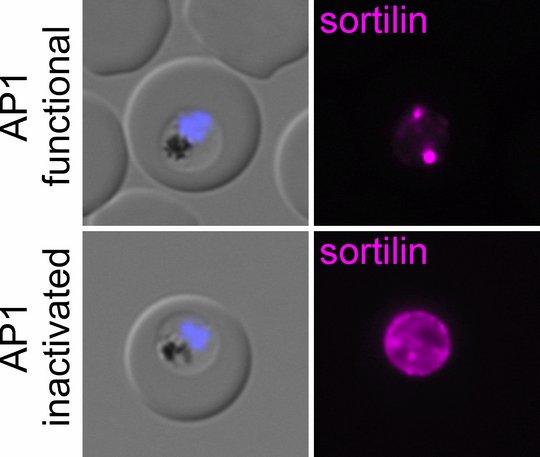
Damit lebenswichtige Eiweiße innerhalb des Malaria-Parasiten an die richtige Stelle gelangen, braucht es ein ausgeklügeltes Transportsystem. Dazu entstehen Transportbläschen, sogenannte Vesikel, die die Eiweiße an ihren Zielort bringen. Transporteiweiße helfen bei der Entstehung dieser Vesikel und beladen sie mit „Frachtproteinen“. Eine Schlüsselrolle spielt dabei der Adapter AP1. Er sorgt dafür, dass die richtigen Frachtproteine in die richtigen Vesikel gelangen. Ein wichtiges Frachtprotein ist der Transportrezeptor Sortilin (in den rechten Bildern in magenta zu sehen). Es bindet weitere Frachtproteine, die auch in den Transportvesikeln landen. AP1 erkennt Sortilin und packt es mitsamt seiner Fracht in das richtige Vesikel. So gelangt die Fracht sicher zum richtigen Ziel innerhalb des Malaria-Parasiten. Wird AP1 inaktiviert (untere Bilderreihe), geht Sortilin auf Irrwege: Weil es nicht mehr von AP1 gepackt wird, landet es nicht mehr in den vorgesehenen Transportbläschen. Es folgt stattdessen einem unkontrollierten Transportfluss bis an den Rand der Zelle. Auch die Fracht gelangt dann nicht mehr an ihren Zielort. Wichtige Proteine kommen dadurch nicht mehr an ihren Wirkungsort, und die Zelle kann nicht mehr funktionieren. Das zeigt, dass AP1 entscheidend für die richtige Verteilung und den Transport wichtiger Proteine im Parasiten ist. Dieses Transportsystem ist damit unerlässlich für das Überleben des Malaria-Parasiten.
Wie Parasiten uralte Zellmechanismen neu nutzen
Bemerkenswerterweise ähnelt der Aufbau dieser Transportmechanismen in Malaria-Parasiten denen anderer Lebewesen, obwohl sich die Organismen im Laufe der Evolution stark voneinander entfernt haben. Gleichzeitig weist das System auch ungewöhnliche Besonderheiten auf, die bisher unbekannt waren.
„Mithilfe modernster Bildgebungs- und Proteinanalysen haben wir festgestellt, dass diese Adaptersysteme ähnlich wie Logistikzentren funktionieren und unerwartet viele Gemeinsamkeiten mit ähnlichen Prozessen in menschlichen Zellen aufweisen“, so Spielmann.

Prof. Markus Meißner, Leiter des Lehrstuhls für Experimentelle Parasitologie an der LMU, und sein Team identifizierten einen neuen Transportweg im Parasiten Toxoplasma gondii. Sie untersuchten ein bisher kaum verstandenes Parasiten-Gen. Es kodiert das Eiweiß Tepsin, das eng mit dem Adapterprotein AP-4 zusammenarbeitet und dafür sorgt, dass kleine Bläschen, sogenannte Vesikel, innerhalb des Parasiten an ihren Bestimmungsort gelangen. Interessant ist, dass dabei auch das Strukturprotein Clathrin eine Rolle spielt. Bei Tieren funktioniert dieser Mechanismus anders: Dort arbeitet der Adapterkomplex AP-4 ohne Clathrin. Pflanzen hingegen nutzen Clathrin aktiv, um Vesikel zu bilden. Genau diesen Mechanismus verwendet auch Toxoplasma gondii. Wie die Studie aus dem Spielmann-Labor zeigt, findet sich dieser Mechanismus auch im Malaria-Parasiten. Diese Entdeckung zeigt, dass Toxoplasma gondii und Malaria-Parasiten im Laufe der Evolution ein hochspezialisiertes, aber dennoch konserviertes Transportsystem entwickelt haben:
„Unsere Ergebnisse zeigen, dass diese Parasiten einen sehr alten Transportmechanismus beibehalten haben, der an ihre einzigartige Biologie angepasst ist“, erklärt Meißner.
Darüber hinaus entdeckte die Gruppe um Dr. Simon Gras an der LMU München, dass Toxoplasma während seines Wachstums und seiner Teilung ständig Teile seiner Außenmembran recycelt. „Wir waren erstaunt, wie dynamisch dieser Prozess ist“, sagt Gras. „Es ist ein brillantes Beispiel dafür, wie die Evolution alte zelluläre Tricks wiederverwendet, um neue Herausforderungen zu lösen.“
Neue Therapien denken
Die Ergebnisse der Forschungsgruppen aus Hamburg und München eröffnen neue Perspektiven auf die grundlegende Zellbiologie der sogenannten apicomplexen Parasiten, zu denen die Malaria- und Toxoplasmose-Parasiten gehören. Die Arbeiten heben sowohl gemeinsame als auch einzigartige biologische Merkmale verschiedener Arten hervor und könnten langfristig dazu beitragen, neue Angriffspunkte für Therapien gegen Malaria und Toxoplasmose zu finden.
Zwei Krankheiten mit weltweiter Bedeutung
Malaria und Toxoplasmose zählen zu den weltweit bedeutendsten Infektionskrankheiten. Zwar gibt es Medikamente gegen Malaria und Toxoplasmose, doch sie wirken nicht in allen Krankheitsstadien, können Nebenwirkungen haben und verlieren teils durch Resistenzen an Wirksamkeit. Neue Wirkstoffe werden benötigt, um die Erreger dauerhaft und gezielt bekämpfen zu können. Ein besseres Verständnis der zellbiologischen Prozesse ist entscheidend, um neue Ansatzpunkte für Therapien und Impfstoffe zu entwickeln.
Malaria und Toxoplasmose werden durch apicomplexe Parasiten verursacht. Dies sind einzellige Erreger, die sich nur innerhalb von Wirtszellen vermehren können. Malaria entsteht, wenn Parasiten der Gattung Plasmodium durch den Stich infizierter Anopheles-Mücken in den menschlichen Blutkreislauf gelangen. Sie lösen hohes Fieber, Schüttelfrost und bei schweren Verläufen lebensbedrohliche Organschäden aus. Jährlich erkranken laut WHO über 240 Millionen Menschen an Malaria. Mehr als 600.000 sterben an den Folgen, vor allem Kinder in Afrika südlich der Sahara. Toxoplasmose, ausgelöst durch den Parasiten Toxoplasma gondii, betrifft weltweit rund ein Drittel der Bevölkerung. Die Infektion verläuft meist unbemerkt, kann aber bei Schwangeren und immungeschwächten Personen schwere Komplikationen verursachen.
Publikationen:
Cubillán-Marín J et al., Vesicle adapters in malaria parasites show conservation and flexibility of protein sorting machinery, Journal of Cell Biology 2025, doi: 10.1083/jcb.202504062
Grech J et al., Tepsin and AP4 mediate transport from the trans-Golgi to the plant-like vacuole in toxoplasma, Journal of Cell Biology 2025, doi: 10.1083/jcb.202312109
Von Knoerzer-Suckow J et al., Plasma membrane recycling drives reservoir formation during Toxoplasma gondii intracellular replication, PLOS Biology 2025, doi: 10.1371/journal.pbio.3003415
Über das Bernhard-Nocht-Institut für Tropenmedizin (BNITM)
Das Bernhard-Nocht-Institut für Tropenmedizin (BNITM) ist Deutschlands größte Einrichtung für Forschung, Versorgung und Lehre auf dem Gebiet tropentypischer und neu auftretender Infektionskrankheiten. Aktuelle thematische Schwerpunkte bilden Malaria, hämorrhagische Fieberviren, vernachlässigte Tropenerkrankungen (NTDs), Immunologie, Epidemiologie und die Klinik tropischer Infektionen sowie die Mechanismen der Übertragung von Viren durch Stechmücken. Für den Umgang mit hochpathogenen Viren und infizierten Insekten verfügt das Institut über Laboratorien der höchsten biologischen Sicherheitsstufe (BSL4) und ein Sicherheits-Insektarium (BSL3).
Über die Ludwig-Maximilians-Universität München (LMU)
Die Ludwig-Maximilians-Universität München ist eine der führenden Universitäten in Europa mit einer über 500-jährigen Tradition. Sie bietet ein breites Spektrum aller Wissensgebiete – die ideale Basis für hervorragende Forschung und ein anspruchsvolles Lehrangebot. Es reicht von den Geistes- und Kultur- über Rechts-, Wirtschafts- und Sozialwissenschaften bis hin zur Medizin und den Naturwissenschaften. 22 Prozent der 53.000 Studierenden kommen aus dem Ausland – aus insgesamt 140 Nationen. Das Know-how und die Kreativität der Wissenschaftlerinnen und Wissenschaftler bilden die Grundlage für die herausragende Forschungsbilanz der Universität. Der Erfolg der LMU in allen drei Phasen des Exzellenz-Wettbewerbs und die dauerhafte Förderung als „Exzellenzuniversität“ dokumentiert eindrucksvoll die Forschungsstärke der Münchener Universität.
Downloads
Ansprechperson
Dr. Tobias Spielmann
Research group leader
Telefon : +49 40 285380-486
E-Mail : spielmann@bnitm.de
Dr. Anna Hein
Presse- & Öffentlichkeitsarbeit
Telefon : +49 40 285380-269
E-Mail : presse@bnitm.de
Weiterführende Informationen
- Cubillán-Marín J et al., Vesicle adapters in malaria parasites show conservation and flexibility of protein sorting machinery
- Grech J et al., Tepsin and AP4 mediate transport from the trans-Golgi to the plant-like vacuole in toxoplasma
- Von Knoerzer-Suckow J et al., Plasma membrane recycling drives reservoir formation during Toxoplasma gondii intracellular replication






